Perangkat Pembelajaran Kimia
Silabus dan RPP Berkarakter Materi Pokok Penyetaraan Reaksi Redoks, Sel Elektrokimia dan Potensial Sel
Sekilas Tentang Redoks dan Sel Elelktrokimia
Sajian materi singkat tentang penyetaraan reaksi redoks, sel elektrokimia dan harga potensial sel
All About Linux
tentang linux dan perkembangannya
All About Android
tentang android dan perkembangannya
Aplikasi Kimia Pendukung
berisi daftar aplikasi kimia untuk mendukung materi redoks dan elektrokimia
Rabu, 15 Januari 2014
Redox Reactions
04.23
No comments
The Eureka.in aplikasi pada Kimia Reaksi Redoks menawarkan wawasan ke dalam kimia di balik reaksi redoks yang melibatkan transfer elektron dari satu atom ke yang lain. Aplikasi ini informatif
• menjelaskan kerugian dan keuntungan elektron dalam atom melalui animasi mengasyikkan
• membantu Anda membedakan antara reaksi redoks langsung dan tidak langsung
Aplikasi ini terutama melayani kebutuhan siswa SMA dan melukai sejumlah fitur tambahan untuk belajar ditingkatkan. Mereka adalah:
• Sebuah teks yang komprehensif untuk mendukung animasi 3D
• Sebuah kuis menantang untuk menilai pengetahuan Anda pada topik
• Sebuah bagian web-link instruktif untuk membaca ekstensif
• Sejumlah gambar yang mengagumkan
• Sebuah bagian penting yang berisi daftar dan menjelaskan istilah kunci
Galvanic cell
04.18
No comments
Man has known, for a very long time that matter can be electrified. However, it is very complex to maintain a separation of charges for the circulation of electric current. It was not until the late eighteenth century and the voltaic cell that we had our first current generator.
In 1836, John Daniell, a British physician (1790-1845), invented a new one cell battery made of two compartments containing respectively ionic aqueous solutions of copper sulphate in which a strip of copper metal has been inserted and zinc sulfate in which a zinc metal strip has been inserted.
The two compartments are connected by a salt bridge. This device can generate a sustainable voltage of 1.1 V.
bisa didownload disini
JEE-Prep-Redox Reaction
04.15
No comments
Konsep Klasik Oksidasi dan Reduksi, Konsep Reaksi Redoks Elektronik, Persamaan Molekuler dan Ionic, Persamaan Molekuler dan Ionic, Nomor Oksidasi, Oksidator dan Mengurangi Agen, Reaksi Redoks dalam rangka Bilangan Oksidasi, Menyeimbangkan Reaksi Redoks oleh Oksidasi Metode Nomor, Ion-elektron Metode Menyeimbangkan Persamaan Redoks, Bobot Setara oksidator Agen, Bobot Setara Mengurangi Agen ada dalam Aplikasi ini.
bisa di download DISINI
JEE-Prep-Electrochemistry
04.07
No comments
Sebuah buku tangan elektrokimia untuk kelas 11,12, JEE dan pengambil tes NEET. Buku ini mencakup semua konsep yang berhubungan dengan elektrokimia. Baik jumlah contoh dipecahkan berada di sana untuk pemahaman yang lebih baik. Cakupan:
Elektrokimia, sel elektrokimia, baterai, sel kering, Timbal penyimpanan baterai asam, Nikel-kadmium sel penyimpanan, sel bahan
bisa didownload DISINI
Periodic table
04.00
No comments
Platform : Windows, Linux, Mac OS
License Status : no downloaded/ dapat dijalankan secara online
Source / Link : http://modelscience.com/PeriodicTable.html
Program ini dapat digunakan untuk mengetahui sifat-sifat unsur dalam periodic tabel. Misalnya untuk melihat oxidation state unsur-unsur. Berikut tampilanya

untuk melihat rincian unsur yang ingin diketahui, klik pada unsur tersebut
CellSchema Aluminum-Smelting
03.59
No comments
The slideshow CellSchema mewakili beberapa
penampang Hall-Heroult elektrolisis sel konvensional untuk peleburan aluminium.
Seperti sel elektrolit dioperasikan pada sekitar 950 ° C dan mengandung karbon
anoda, elektrolit kriolit cair dan pad katoda logam. Slideshow ini menunjukkan
komponen penting dari sel semacam: isolasi termal dari shell pot, lapisan
karbon, sistem makan otomatis untuk bijih alumina, sistem hooding untuk
mengumpulkan gas buang dan sistem bus bar untuk arus listrik.
Menggunakan proses Hall Héroult sekitar 40 mio ton aluminium dilebur setiap
tahun
selengkapnya bisa diliat DISINI
Redox Reactions Calculator
03.53
No comments
Platform : Windows, Linux, Mac OS
Status : No downloaded software, dapat dijalankan secara online
Aplikasi ini digunakan untuk menghitung potensial electrode dari setengah reaksi dalam reaksi redoks.
Input yang dapat dimasukkan, yaitu konsentrasi, koefisien dari reaktan dan produk, serta jumlah elektron tertransfer yang terlibat dalam reaksi setengah reaksi
Berikut tampilannya

Lalu klik ‘Evaluate’„, sebagai output hasil yaitu E0 (tabel) dan potensial electrode reaksi (E).
Atau dapat juga menghitung langsung dari potensial electrode standar setengah reaksidari data yang diketahui„ yaitu masing-masing potensial electrode standar setengah reaksi dari reaksi oksidasi dan reduksi„
Ingat!!! (perhatikan tanda).

Chemputer [Oxidation State (Metal Oxidation Calculator)
03.49
No comments
Platform : Windows, Linux, Mac OS
Status : No downloaded software, dapat dijalankan secara online
Source / Link : http://winter.group.shef.ac.uk/chemputer/oxidation-number.html
Aplikasi ini berguna untuk menghitung bilangan oksidasi pada senyawa khususnya senyawa kompleks. Sebagai contoh, program ini akan menampilkan formasi senyawa kompleks [CoCl2(En)2]+
Terkadang / pada suatu waktu, Chemputer tidak akan menghitung bilangan oksidasi pada senyawa dengan unsur atom pusat yang berada pada blok p

Yang perlu diperhatikan :
1.Tuliskan SIMBOL dari atom pusat
2.Masukkan muatan yang terbentuk dari senyawa kompleks
3.Masukkan jumlah masing-masing ligan pada kompleks
4.Untuk ligan bisa menggunakan NAMA atau SIMBOL,
5.Untuk SIMBOL, gunakan singkatan (lambang unsur), seperti En dan Cl(huruf pertama unsur ditulis kapital).
6.Untuk NAMA, gunakan penulisan semisal chloride atau chloro
Lalu klik, SUBMIT
Lihat hasilnya

Redox v.2.0
03.44
No comments
Nama Program : Redox v.2.0
Platform : Windows XP / Vista / 7
License Status : Freeware
Source / Link : http://www.softpedia.com/get/Science-CAD/REDOX.shtml
Aplikasi ini digunakan untuk mengetahui potensial redoks baik dari reaksi oksidasi maupun reduksi suatu senyawa atau ion.
Tampilannya sebagai berikut
t

Pada program, ada table yang berisi suatu senyawa oksidan dan senyawa reduktan. Pilih masing-masing dari senyawa oksidan dan reduktan tersebut.

Klik tombol Evaluate untuk mengetahui reaksi yang terjadi dan potensial yang dihasilkan.
Reaksi dapat terjadi pada suatu kondisi yang akan disetting, ada kondisi asam, basa, dan kemungkinan semua secara teoritik.
Program aplikasi ini tidak dapat menghitung potensial sel gabungan dari reaksi oksidasi dan reduksi.
Pada program aplikasi ini juga ada pop-up menu, seperti berikut
.

Chemical Equation Balancer
03.32
No comments
Pernah mencoba menyetarakan persamaan kimia tetapi tidak bisa dengan cara manual?
dengan aplikasi ini jangan takut karena bisa menyeimbangkan semua
jenis persamaan dalam sepersekian detik. Cukup ketik persamaan dalam, membuat
elemen dikapitalisasi dan senyawa dipisahkan oleh tanda "+" dan tanda
"=" untuk menunjukkan sisi lain, bersama dengan produk. Sentuh
"Balance" dan persamaan Anda akan seimbang dalam sekejap!
Aplikasi digunakan untuk memasukkan kurung untuk ion poliatomik
dan kurung untuk biaya dalam reaksi oksidasi / reduksi.
Untuk
persamaan yang mengandung ion poliatomik, jika hanya ada satu molekul ion,
seperti pada H (NO3), JANGAN memasukkan tanda kurung, dan sebagai gantinya
masukan HNO3.
Untuk
persamaan redoks, pastikan bahwa setiap senyawa memiliki braket dengan biaya,
bahkan jika senyawa tidak memiliki muatan. Untuk muatan positif, misalnya,
input [2], untuk muatan negatif, [-2], dan untuk biaya 0, [0]. JANGAN INPUT
[2].
Contoh Persamaan:
C6H12O6 + O2 è
CO2 + H2O
H2 + O2 è H2O
AgI + Pb (NO3) 2 è AgNO3 + PbI2
Ca (OH) 2 + (NH4) 3PO4 è
Ca3 (PO4) 2 + NH4OH
Cr2O7 [-2] + H [1] + Fe [2] = Cr [3] + H2O +
Fe [3]
Cu [0] + Ag [1] = Cu [2] + Ag [0]
Aplikasi ini beroperasi secara offline, tanpa
menggunakan internet, dengan hanya menggunakan algoritma matematika untuk
menemukan koefisien senyawa
bisa didownload DISINI
Sekilas Tentang Sel Galvani
03.17
No comments
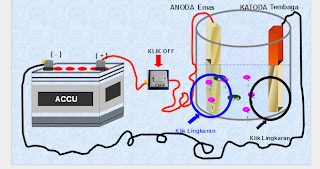
Sel Galvani atau disebut juga dengan sel volta adalah sel elektrokimia yang dapat menyebabkan terjadinya energi listrik dari suatu reaksi redoks yang spontan. reaksi redoks spontan yang dapat mengakibatkan terjadinya energi listrik ini ditemukan oleh Luigi Galvani dan Alessandro Guiseppe Volta.
Sel Volta adalah rangkaian sel yang dapat menghasilkan arus listrik. Dalam sel tersebut terjadi perubahan dari reaksi redoks menghasilkan arus listrik.
Sel volta terdiri atas elektroda tempat berlangsungnya reaksi oksidasi disebut anoda(electrode negative), dan tempat berlangsungnya reaksi reduksi disebut katoda(electrode positif).
Rangkaian Sel Galvani


Contoh rangkaian sel galvani.
sel galvani terdiri dari beberapa bagian, yaitu:
voltmeter, untuk menentukan besarnya potensial sel.
jembatan garam (salt bridge), untuk menjaga kenetralan muatan listrik pada larutan.
anoda, elektroda negatif, tempat terjadinya reaksi oksidasi. pada gambar, yang bertindak sebagai anoda adalah elektroda Zn/seng (zink electrode).
katoda, elektroda positif, tempat terjadinya reaksi reduksi. pada gambar, yang bertindak sebagai katoda adalah elektroda Cu/tembaga (copper electrode).
Proses dalam Sel Galvani
Pada anoda, logam Zn melepaskan elektron dan menjadi Zn2+ yang larut.
Zn(s) → Zn2+(aq) + 2e-
Pada katoda, ion Cu2+ menangkap elektron dan mengendap menjadi logam Cu.
Cu2+(aq) + 2e- → Cu(s)
hal ini dapat diketahui dari berkurangnya massa logam Zn setelah reksi, sedangkan massa logam Cu bertambah. Reaksi total yang terjadi pada sel galvani adalah:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Sel Volta dalam kehidupan sehari – hari :
1. Sel Kering (Sel Leclanche)
 Dikenal sebagai batu baterai. Terdiri dari katode yang berasal dari karbon(grafit) dan anode logam zink. Elektrolit yang dipakai berupa pasta campuran MnO2, serbuk karbon dan NH4Cl.
Dikenal sebagai batu baterai. Terdiri dari katode yang berasal dari karbon(grafit) dan anode logam zink. Elektrolit yang dipakai berupa pasta campuran MnO2, serbuk karbon dan NH4Cl.Persamaan reaksinya :
Katode : 2MnO2 + 2H+ + 2e ” Mn2O3 + H2O
Anode : Zn ” Zn2+ + 2e
Reaksi sel : 2MnO2 + 2H+ + Zn ” Mn2O3 + H2O + Zn2
2. Sel Aki
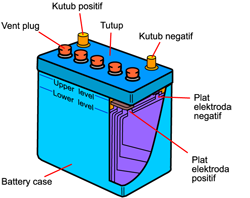 Sel aki disebut juga sebagai sel penyimpan, karena dapat berfungsi penyimpan listrik dan pada setiap saat dapat dikeluarkan . Anodenya terbuat dari logam timbal (Pb) dan katodenya terbuat dari logam timbal yang dilapisi PbO2.Reaksi penggunaan aki :
Sel aki disebut juga sebagai sel penyimpan, karena dapat berfungsi penyimpan listrik dan pada setiap saat dapat dikeluarkan . Anodenya terbuat dari logam timbal (Pb) dan katodenya terbuat dari logam timbal yang dilapisi PbO2.Reaksi penggunaan aki :Anode : Pb + SO4 2- ” PbSO4 + 2e
Katode : PbO2 + SO42-+ 4H++ 2e ” PbSO4 + 2H2O
Reaksi sel : Pb + 2SO4 2- + PbO2 + 4H+ ” 2PbSO4 + 2H2O
Reaksi Pengisian aki :
2PbSO4 + 2H2O ” Pb + 2SO4 2- + PbO2 + 4H+
3. Sel Perak Oksida
Sel ini banyak digunakan untuk alroji, kalkulator dan alat elektronik.
Reaksi yang terjadi :
Anoda : Zn(s) + 2OH-(l) ” Zn(OH)2(s) + 2e
Katoda : Ag2O(s) + H2O(l) + 2e ” 2Ag(s) + 2OH-(aq)
Reaksi Sel : Zn(s) + Ag2O(s) + H2O(l) ” Zn(OH)2(s) + 2Ag(s)
Potensial sel yang dihasilkan adalah 1,34 V
4. Sel Nikel Cadmium (Nikad)
Sel Nikad merupakan sel kering yang dapat diisi kembali (rechargable). Anodenya terbuat dari Cd dan katodenya berupa Ni2O3 (pasta). Beda potensial yang dihasilkan sebesar 1,29 V. Reaksinya dapat balik :
NiO(OH).xH2O + Cd + 2H2O → 2Ni(OH)2.yH2O + Cd(OH)2
5. Sel Bahan Bakar
Sel Bahan bakar merupakan sel Galvani dengan pereaksi – pereaksinya (oksigen dan hidrogen) dialirkan secara kontinyu ke dalam elektrode berpori. Sel ini terdiri atas anode dari nikel, katode dari nikel oksida dan elektrolit KOH.
Reaksi yang terjadi :
Anode : 2H2(g) + 4OH-(aq) → 4H2O(l) + 4e
Katode : O2(g) + 2H2O(l) + 4e → 4OH-(aq)
Reaksi sel : 2H2(g) + O2 → 2H2O(l)
Sel Elektrolisis
03.07
No comments
Sel Elektrolisis adalah sel yang menggunakan arus listrik untuk menghasilkan reaksi redoks yang diinginkan dan digunakan secara luas di dalam masyarakat kita. Baterai aki yang dapat diisi ulang merupakan salah satu contoh aplikasi sel elektrolisis dalam kehidupan sehari-hari. Baterai aki yang sedang diisi kembali (recharge) mengubah energi listrik yang diberikan menjadi produk berupa bahan kimia yang diinginkan. Air, H2O, dapat diuraikan dengan menggunakan listrik dalam sel elektrolisis. Proses ini akan mengurai air menjadi unsur-unsur pembentuknya. Reaksi yang terjadi adalah sebagai berikut :
2 H2O(l) -à 2 H2(g) +
O2(g)
Rangkaian sel
elektrolisis hampir menyerupai sel volta. Yang membedakan sel elektrolisis dari sel volta adalah, pada sel elektrolisis, komponen voltmeter diganti dengan sumber arus (umumnya baterai). Larutan atau lelehan yang ingin
dielektrolisis, ditempatkan dalam suatu wadah. Selanjutnya, elektroda
dicelupkan ke dalam larutan maupun lelehan elektrolit yang ingin
dielektrolisis. Elektroda yang digunakan umumnya merupakan elektroda inert,
seperti Grafit (C), Platina (Pt), dan Emas (Au). Elektroda berperan sebagai
tempat berlangsungnya reaksi. Reaksi reduksi berlangsung di katoda, sedangkan reaksi oksidasi berlangsung di anoda. Kutub negatif
sumber arus mengarah pada katoda (sebab memerlukan elektron) dan kutub positif
sumber arus tentunya mengarah pada anoda. Akibatnya, katoda bermuatan negatif dan
menarik kation-kation yang
akan tereduksi menjadi
endapan logam. Sebaliknya, anoda bermuatan
positif dan menarik anion-anion yang
akanteroksidasi menjadi
gas. Terlihat jelas bahwa tujuan elektrolisis adalah untuk mendapatkan endapan
logam di katoda dan gas di anoda.
Ada dua tipe
elektrolisis, yaitu elektrolisis
lelehan (leburan) dan elektrolisis
larutan. Pada proseselektrolisis
lelehan, kation pasti tereduksi di katoda dan anion pasti
teroksidasi di anoda. Sebagai contoh, berikut ini adalah reaksi
elektrolisis lelehan garam NaCl (yang dikenal dengan istilah sel Downs) :
Katoda
(-)
: 2 Na+(l) + 2 e- à 2 Na(s)---------------------(1)
Anoda
(+)
: 2 Cl-(l) àCl2(g) + 2 e- ------------------------(2)
Reaksi
sel
: 2 Na+(l) + 2 Cl-(l) à 2 Na(s) + Cl2(g) ------[(1)
+ (2)]
Reaksi elektrolisis
lelehan garam NaCl menghasilkan endapan logam natrium di katoda dan
gelembung gas Cl2 di anoda. Bagaimana halnya jika lelehan garam NaCl diganti
dengan larutan garam NaCl?
Apakah proses yang terjadi masih sama? Untuk mempelajari reaksi elektrolisis larutan garam NaCl, kita
mengingat kembali Deret
Volta (lihat Elektrokimia I : Penyetaraan Reaksi Redoks dan Sel
Volta).
Pada katoda,
terjadi persaingan antara air dengan ion Na+. Berdasarkan Tabel Potensial Standar Reduksi, air
memiliki E°red yang
lebih besar dibandingkan ion Na+. Ini berarti, air lebih mudahtereduksi dibandingkan ion Na+.
Oleh sebab itu, spesi yang bereaksi di katoda adalah air. Sementara, berdasarkan Tabel Potensial Standar Reduksi,
nilai Eored ion
Cl- dan air hampir sama. Oleh karena oksidasi air memerlukan
potensial tambahan (overvoltage), maka oksidasi ion Cl- lebih mudah dibandingkan oksidasi air.
Oleh sebab itu, spesi yang bereaksi di anoda adalah ion Cl-. Dengan demikian, reaksi yang
terjadi pada elektrolisis larutan
garam NaCl adalah sebagai berikut :
Katoda
(-)
: 2 H2O(l) + 2 e- à H2(g) + 2 OH-(aq)
--------(1)
Anoda
(+)
: 2 Cl-(aq) à Cl2(g) + 2 e- ----------------(2)
Reaksi
sel
: 2 H2O(l) + 2 Cl-(aq)
àH2(g) + Cl2(g) + 2
OH-(aq) -------[(1) + (2)]
Reaksi elektrolisis larutan garam NaCl menghasilkan
gelembung gas H2 dan ion OH-(basa) di katoda serta
gelembung gas Cl2 di anoda. Terbentuknya ion OH- pada
katoda dapat dibuktikan dengan perubahan warna larutan dari bening menjadi merah
muda setelah diberi sejumlah indikator fenolftalein (pp). Dengan demikian,
terlihat bahwa produk elektrolisis lelehan umumnya berbeda dengan produk
elektrolisis larutan.
Selanjutnya kita mencoba
mempelajari elektrolisis larutan Na2SO4. Pada katoda, terjadi persaingan antara air
dan ion Na+. Berdasarakan nilai Eored, maka air yang akan tereduksi di katoda. Di lain sisi, terjadi
persaingan antara ion SO42- dengan air di anoda. Oleh karena bilangan
oksidasi S pada SO4-2telah mencapai
keadaan maksimumnya, yaitu +6, maka spesi SO42- tidak
dapat mengalami oksidasi. Akibatnya, spesi air yang akan teroksidasi di anoda. Reaksi yang terjadi adalah
sebagai berikut :
Katoda
(-)
: 4 H2O(l) + 4 e- à 2 H2(g) + 4 OH-(aq) ---------(1)
Anoda (+)
: 2 H2O(l) à O2(g) + 4 H+(aq) +
4 e-------------(2)
Reaksi
sel :
6 H2O(l) à 2 H2(g) +
O2(g) + 4 H+(aq) + 4 OH-(aq) ---
[(1) + (2)]
6 H2O(l) à 2 H2(g) + O2(g) +
4 H2O(l) ----------- [(1) + (2)]
2 H2O(l) à 2 H2(g) + O2(g) --------------------[(1)
+ (2)]
Dengan demikian, baik ion Na+ maupun SO42-,
tidak bereaksi. Yang terjadi justru adalah peristiwa elektrolisis air menjadi
unsur-unsur pembentuknya. Hal yang serupa juga ditemukan pada proses
elektrolisis larutan Mg(NO3)2 dan K2SO4.
Bagaimana halnya jika elektrolisis lelehan maupun larutan
menggunakan elektroda yang tidak inert, seperti Ni, Fe, dan Zn? Ternyata,
elektroda yang tidak inert hanya dapat bereaksi di anoda, sehingga produk yang dihasilkan di anoda adalah ion elektroda yang
larut (sebab logam yang tidak inert mudah teroksidasi). Sementara, jenis
elektroda tidak mempengaruhi produk yang dihasilkan di katoda. Sebagai contoh, berikut adalah
proses elektrolisis larutan garam NaCl dengan menggunakan elektroda Cu :
Katoda
(-)
: 2 H2O(l) + 2 e- à H2(g) + 2 OH-(aq) ----------(1)
Anoda
(+)
: Cu(s) à Cu2+(aq) +
2 e- ---------------------(2)
Reaksi
sel
: Cu(s) + 2 H2O(l) à Cu2+(aq) + H2(g) +
2 OH-(aq) -----[(1) + (2)]
Dari pembahasan di atas,
kita dapat menarik beberapa kesimpulan yang berkaitan dengan reaksi
elektrolisis :
- Baik elektrolisis lelehan maupun
larutan, elektroda inert tidak akan bereaksi; elektroda tidak inert hanya
dapat bereaksi di anoda
- Pada elektrolisis lelehan, kation
pasti bereaksi di katoda dan anion pasti bereaksi di anoda
- Pada elektrolisis larutan, bila
larutan mengandung ion alkali, alkali tanah, ion aluminium, maupun ion
mangan (II), maka air yang mengalami reduksi di katoda
- Pada elektrolisis larutan, bila
larutan mengandung ion sulfat, nitrat, dan ion sisa asam oksi, maka air
yang mengalami oksidasi di anoda
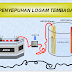
Salah satu aplikasi sel elektrolisis adalah pada proses yang
disebut penyepuhan. Dalam
proses penyepuhan, logam yang
lebih mahal dilapiskan (diendapkan sebagai lapisan tipis) pada permukaan logam
yang lebih murah dengan cara elektrolisis. Baterai umumnya digunakan sebagai
sumber listrik selama proses penyepuhan berlangsung.
Logam yang ingin disepuh berfungsi sebagai katoda dan lempeng perak (logam pelapis) yang merupakan logam
penyepuh berfungsi sebagai anoda.
Larutan elektrolit yang digunakan harus mengandung spesi ion logam yang sama
dengan logam penyepuh (dalam hal ini, ion perak). Pada proses elektrolisis,
lempeng perak di anoda akan teroksidasi dan larut menjadi ion perak. Ion perak
tersebut kemudian akan diendapkan sebagai lapisan tipis pada permukaan katoda.
Metode ini relatif mudah dan tanpa biaya yang mahal, sehingga banyak digunakan
pada industri perabot rumah tangga dan peralatan dapur.
REAKSI OKSIDASI REDUKSI ( R E D O K S )
03.02
No comments
Pengertian oksidasi dan reduksi dapat ditinjau berdasarkan
3 landasan teori, yaitu :
1. Reaksi Pengikatan dan
pelepasan unsur oksigen
Reaksi oksidasi (pengoksigenan) adalah peristiwa
penggabungan suatu zat dengan oksigen.
Contoh:
Si + O2 → SiO2
4 Fe + 3 O2 → 2 Fe2O3
Reaksi oksidasi logam dikenal juga dengan nama perkaratan.
Reaksi pembakaran juga termasuk reaksi oksidasi, misalnya pembakaran minyak
bumi, kertas, kayu bakar, dll.
Reaksi reduksi adalah peristiwa pengeluaran oksigen dari
suatu zat.
Contoh:
2 CuO → 2
Cu + O2
H2O →
H2 + O2
2. Reaksi pelepasan dan pengikatan elektron
Reaksi oksidasi dan reduksi juga dapat dibedakan dari
pelepasan dan penangkapan elektron.
Oksidasi adalah peristiwa pelepasan elektron
Contoh:
Na →
Na + + e
Zn →
Zn +2 + 2e
Al →
Al +3 + 3e
Reduksi adalah peristiwa penangkapan elektron
Contoh:
Na + +
e → Na
Fe +3 +
e → Fe +2
Dari konsep kedua ini
dapat disimpulkan bahwa reaksi oksidasi dan reduksi tidak hanya hanya
melibatkan reaksi suatu zat dengan oksigen.
3. Reaksi penambahan dan
pengurangan bilangan oksidasi
Oksidasi adalah peristiwa naiknya / bertambahnya bilangan
oksidasi suatu unsur, sedangkan reduksi adalah peristiwa turunnya /
berkurangnya bilangan oksidasi.
B. BILANGAN OKSIDASI
Bilangan oksidasi ( biloks) disebut juga tingkat oksidasi.
Bilangan oksidasi diartikan sebagai muatan yang dimiliki suatu atom dalam
keadaan bebas atau dalam senyawa yang dibentuknya.
Bilangan oksidasi suatu unsur dapat ditentukan dengan
aturan berikut:
1. Biloks atom dalam
unsur adalah nol
Contoh Na, Fe, O2
, H2 memiliki biloks nol
2. Total biloks senyawa
adalah nol
Contoh H2O, NaOH, CH3COOH, KNO3
total biloksnya adalah nol
3. Biloks ion sesuai
dengan muatannya
Contoh Na +1
( = +1), O -2 ( = -2), Fe +3 (= +3)
4. Biloks unsur golongan
I A dalam senyawanya adalah + 1
Contoh Biloks atom Na dalam NaCl adalah + 1
5. Biloks unsur golongan
II A dalam senyawanya adalah + 2
Contoh: Biloks Ca
dalam CaCO3 adalah + 2
6. Biloks unsur golongan
VII A dalam senyawa binernya adalah – 1
Contoh: Biloks F dalam senyawa KF dan BaF2
adalah – 1
7. Biloks unsur oksigen
dalam senyawanya adalah – 2
Contoh dalam H2O, Na2O, Al2O3
8. Biloks unsur hydrogen
dalam senyawanya adalah + 1
Contoh dalam H2O, HCl, H2SO4
Catatan Penting:
Biloks H = -1
dalam senyawa hidrida misal NaH, LiH, CaH2
Biloks O = -1
dalam senyawa peroksida misal H2O2
C. OKSIDATOR DAN REDUKTOR
Oksidator adalah istilah untuk zat yang mengalami reduksi
(biloksnya turun), sedangkan Reduktor adalah zat yang mengalami reaksi oksidasi (biloksnya naik/bertambah).
Contoh:
Pada
reaksi 2Na + 2H2O → 2NaOH
+ H2
Reduktor
adalah Na sebab biloksnya naik dari 0 ke +1
Oksidator
adalah H2O sebab biloks H berubah dari +1 ke 0
Selesaikan soal berikut
ini!
D. TATA
NAMA SENYAWA
Senyawa biner adalah senyawa yang dibentuk oleh dua macam
unsur, dapat terdiri ataslogam dan non logam atau keduanya non logam. Untuk
senyawa yang terdiri atas logam dan non logam, maka unsur logam dituliskan
terlebih dahulu diikuti dengan non logam.
Untuk unsur-unsur logam yang mempunyai lebih dari satu
macam bilangan oksidasi diberi nama berdasarkan system Stock, yaitu dengan
membubuhkan angka Romawi yang sesuai dengan bilangan oksidasi unsure logam
dalam tanda kurung dibelakang nama logam dan diikuti nama unsure non logam
dengan akhiran ida.
Contoh:
FeCl2 besi(II)klorida
FeCl3 besi(III)klorida
Cu2O tembaga(I)oksida
CuO tembaga(II)oksida
SnCl2 timah(II)klorida
SnCl4 timah(IV)klorida
E. PENGOLAHAN LOGAM
Peranan unsur logam dalam kehidupan sehari-hari dapat
dilihat dari banyaknya logam yang digunakan. Antara lain untuk membuat
mesin-mesin, kendaraan, bangunan, pekakas rumah tangga, dan sebagainya. Logam
yang banyak digunakan untuk kesejahteraan manusia diantaranya besi, alumunium,
tembaga, perak, emas, nikel, dan timah.
Pada umumnya pemisahan logam dari bijihnya dilakukan
berdasarkan reaksi reduksi. Cara reduksi yang paling murah adalah reduksi
oksida logam dengan karbon. Metoda ini cocok dilakukan untuk pengolahan besi
dan timah.
Untuk memperoleh logam dari sulfida logam, mula-mula
sulfida logam dipanggang diudara untuk menghasilkan oksida logam. Kemudian
oksida logam direduksi dengan karbon atau karbon monoksida. Logam-logam yang
sangat reaktif seperti alumunium diperoleh dengan cara elektrolisis.
Beberapa contoh reaksi
pengolahan logam:
Pengolahan besi
Fe2O3 +
3 CO → 2
Fe + 3 CO2
Pengolahan nikel
2 NiO + C →
2 Ni + CO2
Pengolahan Alumunium
Al2O3 +
C → 4 Al
+ 3 CO2
Pengolahan Timah
SnO2
+ C → Sn +
CO2
Pengolahan tembaga
2 Cu2O
+ Cu2S →
6 Cu + SO2
Langganan:
Komentar (Atom)