Sel Galvani atau disebut juga dengan sel volta adalah sel elektrokimia yang dapat menyebabkan terjadinya energi listrik dari suatu reaksi redoks yang spontan. reaksi redoks spontan yang dapat mengakibatkan terjadinya energi listrik ini ditemukan oleh Luigi Galvani dan Alessandro Guiseppe Volta.
Sel Volta adalah rangkaian sel yang dapat menghasilkan arus listrik. Dalam sel tersebut terjadi perubahan dari reaksi redoks menghasilkan arus listrik.
Sel volta terdiri atas elektroda tempat berlangsungnya reaksi oksidasi disebut anoda(electrode negative), dan tempat berlangsungnya reaksi reduksi disebut katoda(electrode positif).
Rangkaian Sel Galvani


Contoh rangkaian sel galvani.
sel galvani terdiri dari beberapa bagian, yaitu:
voltmeter, untuk menentukan besarnya potensial sel.
jembatan garam (salt bridge), untuk menjaga kenetralan muatan listrik pada larutan.
anoda, elektroda negatif, tempat terjadinya reaksi oksidasi. pada gambar, yang bertindak sebagai anoda adalah elektroda Zn/seng (zink electrode).
katoda, elektroda positif, tempat terjadinya reaksi reduksi. pada gambar, yang bertindak sebagai katoda adalah elektroda Cu/tembaga (copper electrode).
Proses dalam Sel Galvani
Pada anoda, logam Zn melepaskan elektron dan menjadi Zn2+ yang larut.
Zn(s) → Zn2+(aq) + 2e-
Pada katoda, ion Cu2+ menangkap elektron dan mengendap menjadi logam Cu.
Cu2+(aq) + 2e- → Cu(s)
hal ini dapat diketahui dari berkurangnya massa logam Zn setelah reksi, sedangkan massa logam Cu bertambah. Reaksi total yang terjadi pada sel galvani adalah:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Sel Volta dalam kehidupan sehari – hari :
1. Sel Kering (Sel Leclanche)
 Dikenal sebagai batu baterai. Terdiri dari katode yang berasal dari karbon(grafit) dan anode logam zink. Elektrolit yang dipakai berupa pasta campuran MnO2, serbuk karbon dan NH4Cl.
Dikenal sebagai batu baterai. Terdiri dari katode yang berasal dari karbon(grafit) dan anode logam zink. Elektrolit yang dipakai berupa pasta campuran MnO2, serbuk karbon dan NH4Cl.Persamaan reaksinya :
Katode : 2MnO2 + 2H+ + 2e ” Mn2O3 + H2O
Anode : Zn ” Zn2+ + 2e
Reaksi sel : 2MnO2 + 2H+ + Zn ” Mn2O3 + H2O + Zn2
2. Sel Aki
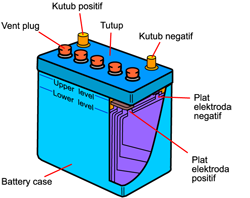 Sel aki disebut juga sebagai sel penyimpan, karena dapat berfungsi penyimpan listrik dan pada setiap saat dapat dikeluarkan . Anodenya terbuat dari logam timbal (Pb) dan katodenya terbuat dari logam timbal yang dilapisi PbO2.Reaksi penggunaan aki :
Sel aki disebut juga sebagai sel penyimpan, karena dapat berfungsi penyimpan listrik dan pada setiap saat dapat dikeluarkan . Anodenya terbuat dari logam timbal (Pb) dan katodenya terbuat dari logam timbal yang dilapisi PbO2.Reaksi penggunaan aki :Anode : Pb + SO4 2- ” PbSO4 + 2e
Katode : PbO2 + SO42-+ 4H++ 2e ” PbSO4 + 2H2O
Reaksi sel : Pb + 2SO4 2- + PbO2 + 4H+ ” 2PbSO4 + 2H2O
Reaksi Pengisian aki :
2PbSO4 + 2H2O ” Pb + 2SO4 2- + PbO2 + 4H+
3. Sel Perak Oksida
Sel ini banyak digunakan untuk alroji, kalkulator dan alat elektronik.
Reaksi yang terjadi :
Anoda : Zn(s) + 2OH-(l) ” Zn(OH)2(s) + 2e
Katoda : Ag2O(s) + H2O(l) + 2e ” 2Ag(s) + 2OH-(aq)
Reaksi Sel : Zn(s) + Ag2O(s) + H2O(l) ” Zn(OH)2(s) + 2Ag(s)
Potensial sel yang dihasilkan adalah 1,34 V
4. Sel Nikel Cadmium (Nikad)
Sel Nikad merupakan sel kering yang dapat diisi kembali (rechargable). Anodenya terbuat dari Cd dan katodenya berupa Ni2O3 (pasta). Beda potensial yang dihasilkan sebesar 1,29 V. Reaksinya dapat balik :
NiO(OH).xH2O + Cd + 2H2O → 2Ni(OH)2.yH2O + Cd(OH)2
5. Sel Bahan Bakar
Sel Bahan bakar merupakan sel Galvani dengan pereaksi – pereaksinya (oksigen dan hidrogen) dialirkan secara kontinyu ke dalam elektrode berpori. Sel ini terdiri atas anode dari nikel, katode dari nikel oksida dan elektrolit KOH.
Reaksi yang terjadi :
Anode : 2H2(g) + 4OH-(aq) → 4H2O(l) + 4e
Katode : O2(g) + 2H2O(l) + 4e → 4OH-(aq)
Reaksi sel : 2H2(g) + O2 → 2H2O(l)







0 komentar:
Posting Komentar