Sel Elektrolisis adalah sel yang menggunakan arus listrik untuk menghasilkan reaksi redoks yang diinginkan dan digunakan secara luas di dalam masyarakat kita. Baterai aki yang dapat diisi ulang merupakan salah satu contoh aplikasi sel elektrolisis dalam kehidupan sehari-hari. Baterai aki yang sedang diisi kembali (recharge) mengubah energi listrik yang diberikan menjadi produk berupa bahan kimia yang diinginkan. Air, H2O, dapat diuraikan dengan menggunakan listrik dalam sel elektrolisis. Proses ini akan mengurai air menjadi unsur-unsur pembentuknya. Reaksi yang terjadi adalah sebagai berikut :
2 H2O(l) -à 2 H2(g) +
O2(g)
Rangkaian sel
elektrolisis hampir menyerupai sel volta. Yang membedakan sel elektrolisis dari sel volta adalah, pada sel elektrolisis, komponen voltmeter diganti dengan sumber arus (umumnya baterai). Larutan atau lelehan yang ingin
dielektrolisis, ditempatkan dalam suatu wadah. Selanjutnya, elektroda
dicelupkan ke dalam larutan maupun lelehan elektrolit yang ingin
dielektrolisis. Elektroda yang digunakan umumnya merupakan elektroda inert,
seperti Grafit (C), Platina (Pt), dan Emas (Au). Elektroda berperan sebagai
tempat berlangsungnya reaksi. Reaksi reduksi berlangsung di katoda, sedangkan reaksi oksidasi berlangsung di anoda. Kutub negatif
sumber arus mengarah pada katoda (sebab memerlukan elektron) dan kutub positif
sumber arus tentunya mengarah pada anoda. Akibatnya, katoda bermuatan negatif dan
menarik kation-kation yang
akan tereduksi menjadi
endapan logam. Sebaliknya, anoda bermuatan
positif dan menarik anion-anion yang
akanteroksidasi menjadi
gas. Terlihat jelas bahwa tujuan elektrolisis adalah untuk mendapatkan endapan
logam di katoda dan gas di anoda.
Ada dua tipe
elektrolisis, yaitu elektrolisis
lelehan (leburan) dan elektrolisis
larutan. Pada proseselektrolisis
lelehan, kation pasti tereduksi di katoda dan anion pasti
teroksidasi di anoda. Sebagai contoh, berikut ini adalah reaksi
elektrolisis lelehan garam NaCl (yang dikenal dengan istilah sel Downs) :
Katoda
(-)
: 2 Na+(l) + 2 e- à 2 Na(s)---------------------(1)
Anoda
(+)
: 2 Cl-(l) àCl2(g) + 2 e- ------------------------(2)
Reaksi
sel
: 2 Na+(l) + 2 Cl-(l) à 2 Na(s) + Cl2(g) ------[(1)
+ (2)]
Reaksi elektrolisis
lelehan garam NaCl menghasilkan endapan logam natrium di katoda dan
gelembung gas Cl2 di anoda. Bagaimana halnya jika lelehan garam NaCl diganti
dengan larutan garam NaCl?
Apakah proses yang terjadi masih sama? Untuk mempelajari reaksi elektrolisis larutan garam NaCl, kita
mengingat kembali Deret
Volta (lihat Elektrokimia I : Penyetaraan Reaksi Redoks dan Sel
Volta).
Pada katoda,
terjadi persaingan antara air dengan ion Na+. Berdasarkan Tabel Potensial Standar Reduksi, air
memiliki E°red yang
lebih besar dibandingkan ion Na+. Ini berarti, air lebih mudahtereduksi dibandingkan ion Na+.
Oleh sebab itu, spesi yang bereaksi di katoda adalah air. Sementara, berdasarkan Tabel Potensial Standar Reduksi,
nilai Eored ion
Cl- dan air hampir sama. Oleh karena oksidasi air memerlukan
potensial tambahan (overvoltage), maka oksidasi ion Cl- lebih mudah dibandingkan oksidasi air.
Oleh sebab itu, spesi yang bereaksi di anoda adalah ion Cl-. Dengan demikian, reaksi yang
terjadi pada elektrolisis larutan
garam NaCl adalah sebagai berikut :
Katoda
(-)
: 2 H2O(l) + 2 e- à H2(g) + 2 OH-(aq)
--------(1)
Anoda
(+)
: 2 Cl-(aq) à Cl2(g) + 2 e- ----------------(2)
Reaksi
sel
: 2 H2O(l) + 2 Cl-(aq)
àH2(g) + Cl2(g) + 2
OH-(aq) -------[(1) + (2)]
Reaksi elektrolisis larutan garam NaCl menghasilkan
gelembung gas H2 dan ion OH-(basa) di katoda serta
gelembung gas Cl2 di anoda. Terbentuknya ion OH- pada
katoda dapat dibuktikan dengan perubahan warna larutan dari bening menjadi merah
muda setelah diberi sejumlah indikator fenolftalein (pp). Dengan demikian,
terlihat bahwa produk elektrolisis lelehan umumnya berbeda dengan produk
elektrolisis larutan.
Selanjutnya kita mencoba
mempelajari elektrolisis larutan Na2SO4. Pada katoda, terjadi persaingan antara air
dan ion Na+. Berdasarakan nilai Eored, maka air yang akan tereduksi di katoda. Di lain sisi, terjadi
persaingan antara ion SO42- dengan air di anoda. Oleh karena bilangan
oksidasi S pada SO4-2telah mencapai
keadaan maksimumnya, yaitu +6, maka spesi SO42- tidak
dapat mengalami oksidasi. Akibatnya, spesi air yang akan teroksidasi di anoda. Reaksi yang terjadi adalah
sebagai berikut :
Katoda
(-)
: 4 H2O(l) + 4 e- à 2 H2(g) + 4 OH-(aq) ---------(1)
Anoda (+)
: 2 H2O(l) à O2(g) + 4 H+(aq) +
4 e-------------(2)
Reaksi
sel :
6 H2O(l) à 2 H2(g) +
O2(g) + 4 H+(aq) + 4 OH-(aq) ---
[(1) + (2)]
6 H2O(l) à 2 H2(g) + O2(g) +
4 H2O(l) ----------- [(1) + (2)]
2 H2O(l) à 2 H2(g) + O2(g) --------------------[(1)
+ (2)]
Dengan demikian, baik ion Na+ maupun SO42-,
tidak bereaksi. Yang terjadi justru adalah peristiwa elektrolisis air menjadi
unsur-unsur pembentuknya. Hal yang serupa juga ditemukan pada proses
elektrolisis larutan Mg(NO3)2 dan K2SO4.
Bagaimana halnya jika elektrolisis lelehan maupun larutan
menggunakan elektroda yang tidak inert, seperti Ni, Fe, dan Zn? Ternyata,
elektroda yang tidak inert hanya dapat bereaksi di anoda, sehingga produk yang dihasilkan di anoda adalah ion elektroda yang
larut (sebab logam yang tidak inert mudah teroksidasi). Sementara, jenis
elektroda tidak mempengaruhi produk yang dihasilkan di katoda. Sebagai contoh, berikut adalah
proses elektrolisis larutan garam NaCl dengan menggunakan elektroda Cu :
Katoda
(-)
: 2 H2O(l) + 2 e- à H2(g) + 2 OH-(aq) ----------(1)
Anoda
(+)
: Cu(s) à Cu2+(aq) +
2 e- ---------------------(2)
Reaksi
sel
: Cu(s) + 2 H2O(l) à Cu2+(aq) + H2(g) +
2 OH-(aq) -----[(1) + (2)]
Dari pembahasan di atas,
kita dapat menarik beberapa kesimpulan yang berkaitan dengan reaksi
elektrolisis :
- Baik elektrolisis lelehan maupun
larutan, elektroda inert tidak akan bereaksi; elektroda tidak inert hanya
dapat bereaksi di anoda
- Pada elektrolisis lelehan, kation
pasti bereaksi di katoda dan anion pasti bereaksi di anoda
- Pada elektrolisis larutan, bila
larutan mengandung ion alkali, alkali tanah, ion aluminium, maupun ion
mangan (II), maka air yang mengalami reduksi di katoda
- Pada elektrolisis larutan, bila
larutan mengandung ion sulfat, nitrat, dan ion sisa asam oksi, maka air
yang mengalami oksidasi di anoda
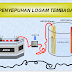
Salah satu aplikasi sel elektrolisis adalah pada proses yang
disebut penyepuhan. Dalam
proses penyepuhan, logam yang
lebih mahal dilapiskan (diendapkan sebagai lapisan tipis) pada permukaan logam
yang lebih murah dengan cara elektrolisis. Baterai umumnya digunakan sebagai
sumber listrik selama proses penyepuhan berlangsung.
Logam yang ingin disepuh berfungsi sebagai katoda dan lempeng perak (logam pelapis) yang merupakan logam
penyepuh berfungsi sebagai anoda.
Larutan elektrolit yang digunakan harus mengandung spesi ion logam yang sama
dengan logam penyepuh (dalam hal ini, ion perak). Pada proses elektrolisis,
lempeng perak di anoda akan teroksidasi dan larut menjadi ion perak. Ion perak
tersebut kemudian akan diendapkan sebagai lapisan tipis pada permukaan katoda.
Metode ini relatif mudah dan tanpa biaya yang mahal, sehingga banyak digunakan
pada industri perabot rumah tangga dan peralatan dapur.








0 komentar:
Posting Komentar